B1 – Einfluss artifizieller und nativer extrazellulärer Matrizes auf die Adhäsion und Differenzierung von mesenchymalen Stammzellen und Osteoblasten
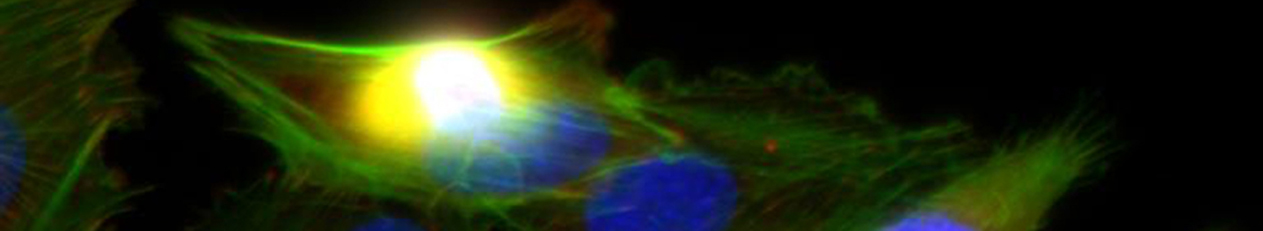
Artifizielle extrazelluläre Matrizes (aEZM) aus Kollagen und sulfatierten Glykosaminoglykan-Derivaten (sGAG) fördern gezielt die osteogene Differenzierung humaner mesenchymaler Stammzellen (hMSC). Die Wirkung der sGAG kann sowohl mit modifizierten 2D-Beschichtungen (aEZM aus Kol/sGAG, A3) als auch mit 3D-Netzwerken (B10, 3D-Kol) nachgewiesen werden.
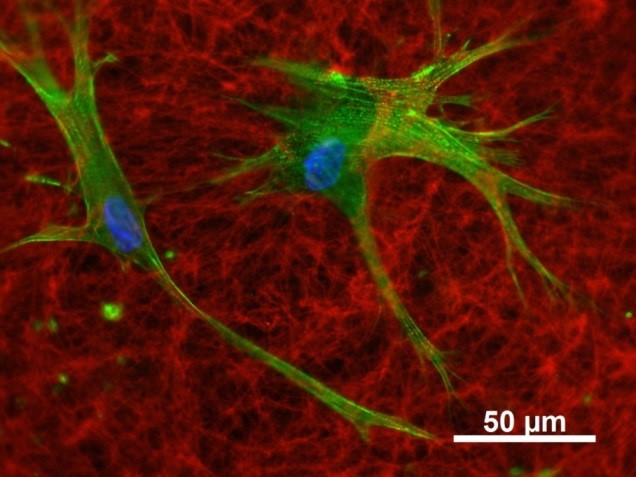
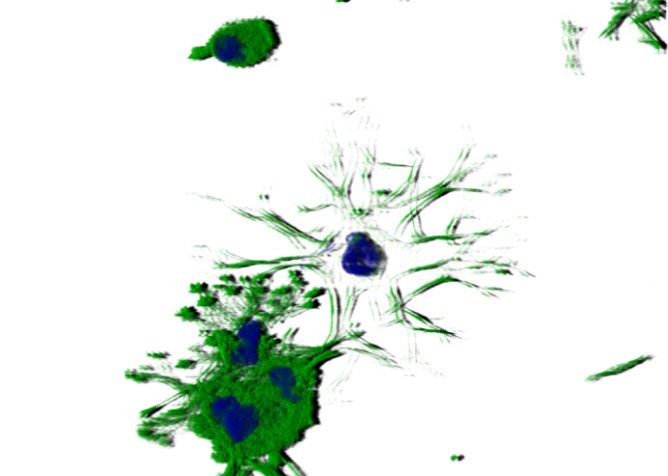
Neben den Effekten auf die osteogene Differenzierung der hMSC verändern aEZM/sGAG-Derivate erheblich die von hMSC sezernierte (native (n)) EZM. sGAG-Derivate interagieren mit Matrixvesikeln, kolokalisieren mit zahlreichen nEZM-Proteinen (z.B. Fibronektin) und werden in das komplexe nEZM-Netzwerk integriert. Dadurch wird nicht nur die Zusammensetzung der nEZM, sondern auch ihre Assemblierung, Vernetzung, Remodelierung und Mineralisierung beeinflusst (Kooperationen mit Z4 (Proteomics-Analysen), A3 (SPR (surface plasmon resonance)-Untersuchungen), A7 (Modellierungen) und mit der Arbeitsgruppe von Prof. Viola Vogel an der ETH Zürich (FRET-FN, fiber stretch assay).
Um die Bedeutung der EZM-Beschaffenheit für die osteogene Differenzierung der hMSC besser zu verstehen, werden sGAG-induzierte Veränderungen der Struktur, Zusammensetzung und physikochemische Eigenschaften der nEZM sowie der Phosphorylierungsstatus einzelner nEZM-Proteine in Kooperation mit A3, A6 A8, B10 und Z4 detaillierter charakterisiert. Die zentrale Arbeitshypothese des TPB1 lautet: Der pro-osteogene Effekt der aEZM/sGAG-Derivate beruht hauptsächlich auf sGAG-induzierten Veränderungen der nativen hMSC-EZM, weshalb auch die durch sGAG-Derivate veränderte nEZM zur Modifikation von Biomaterialoberflächen genutzt werden soll. Weiter ist bekannt, dass sich sGAG-Derivate lysosomal anreichern; es wird vermutet, dass der Endozytose-Rezeptor LRP-1/CD91 (low density lipoprotein receptor-related protein-1) an der Aufnahme der sGAG-Derivate beteiligt ist. Gemeinsam mit Z4 und A3 ist deshalb geplant, mit Hilfe von pull down-Experimenten und SPR-Analysen intrazelluläre Interaktionspartner der sGAG zu identifizieren und Zusammenhänge zu Signal-wegen und zellulären Funktionen aufzuzeigen.
Im Sinne der Gesamtstrategie des TRR 67 fokussieren die Untersuchungen mit hMSC in der 3. Antragsperiode weiterführend auf präklinischen, translationalen Fragestellungen: Gemeinsam mit den der Arbeitrgruppe von Vuk Savkovic und B5 wird geprüft, ob aEZM und sGAG-Derivate, die osteogene Differenzierung der aus Fettgewebe und nicht-invasiv aus Haarfollikeln isolierten hMSC stützen und ob hMSC, die von Patienten mit gestörter Knochenheilung stammen, von den pro-osteogenen und anti-entzündlichen Eigenschaften der aEZM/sGAG profitieren.
Publikationen
- Vogel S, Ullm F, Müller CD, Pompe T, Hempel U. Impact of binding mode of low-sulfated hyaluronan to 3D collagen matrices on its osteoinductive effect for human bone marrow stromal cells. Biological Chemistry, vol. 402, no. 11, 2021, pp. 1465-1478. https://doi.org/10.1515/hsz-2021-0212.
- Balamurugan K, Koehler L, Dürig JN, Hempel U, Rademann J, Hintze V, Pisabarro MT. Structural insights into the modulation of PDGF/PDGFR-β complexation by hyaluronan derivatives. Biological Chemistry, vol. 402, no. 11, 2021, pp. 1441-1452. https://doi.org/10.1515/hsz-2021-0173.
- Großkopf H, Vogel S, Müller CD, Köhling S, Dürig JN, Möller S, Schnabelrauch M, Rademann J, Hempel U, von Bergen M, Schubert K. Identification of intracellular glycosaminoglycan-interacting proteins by affinity purification mass spectrometry. Biological Chemistry, vol. 402, no. 11, 2021, pp. 1427-1440. https://doi.org/10.1515/hsz-2021-0167.
- Ruiz-Gómez G, Vogel S, Möller S, Pisabarro MT, Hempel U. Glycosaminoglycans influence enzyme activity of MMP2 and MMP2/TIMP3 complex formation – Insights at cellular and molecular level. Sci Rep 2019;9:4905,1-15. doi:10.1038/s41598-019-41355-2
- Schmidt JR, Vogel S, Moeller S, Kalkhof S, Schubert K, von Bergen M, Hempel U. Sulfated hyaluronic acid and dexamethasone possess a synergistic potential in the differentiation of osteoblasts from human bone marrow stromal cells. J Cell Biochem 2019;120:8706-8722. doi:10.1002/jcb.28158
- Schulze S, Wehrum D, Dieter P, Hempel U. A supplement-free osteoclast-osteoblast co-culture for preclinical application. J Cell Physiol 2018;233:4391-4400
- Rother S, Galiazzo V, Kilian D, Fiebig K, Becher J, Möller S, Hempel U, Schnabelrauch M, Waltenberger J, Scharnweber D, Hintze V. Hyaluronan/collagen hydrogels with sulfated hyaluronan for improved repair of vascularized tissue tune the binding of proteins and promote endothelial cell growth. Macromolecular Bioscience. 2017 Nov;17(11).doi: 10.1002/mabi.201700154
- Köhler L, Samsonov S, Rother S, Vogel S; Köhling S, Möller S, Schnabelrauch M, Rademann J, Hempel U, Pisabarro MT, Scharnweber D, Hintze V. Sulfated hyaluronan derivatives modulate TGF-ß1:receptor complex formation: Possible consequences for TGF- ß1 signaling. Scientific Reports. 2017;7:1210.
- Vogel S, Arnoldini S, Möller S, Schnabelrauch M, Hempel U. Sulfated hyaluronan alters fibron-ectin matrix assembly and promotes osteogenic differentiation of human bone marrow stromal cells. Sci Rep. 2016;6:36418.
- Schmidt J, Kliemt S, Preissler C, Möller S, von Bergen M, Hempel U*, Kalkhof S*. Osteoblast-released matrix vesicles – Regulation of activity and composition by sulfated and non-sulfated glycosaminoglycans. Mol Cell Proteomics. 2016;15:558-572. (*geteilte Seniorautorschaft)
- Hempel U, Müller K, Preissler C, Noack C, Boxberger S, Dieter P, Bornhäuser M, Wobus M. Human bone marrow stromal cells: A reliable, challenging tool for in vitro osteogenesis and bone engineering approaches. Stem Cells Int. 2016;7842191.
- Lutter AH, Hempel U, Anderer U, Dieter P. Biphasic influence of PGE2 on the resorption activity of osteoclast-like cells derived from human peripheral blood monocytes and mouse RAW264.7 cells. PLEFA. 2016;111:1-7.
- Rother S, Samsonov S, Hempel U, Vogel S, Möller S, Blaszkiewicz J, Köhling S, Schnabelrauch M, Rademann J, Pisabarro MT, Hintze V, Scharnweber, D. Sulfated Hyaluronan Alters the Interaction Profile of TIMP-3 with the Endocytic Receptor LRP-1 Clusters II and IV and Increases the Extracellular TIMP-3 Level of Human Bone Marrow Stromal Cells. Biomacromolecules. 2016;17:3252-61.
- Noack C, Hempel U, Preissler C, Dieter P. Prostaglandin E2 impairs osteogenic and facilitates adipogenic differentiation of human mesenchymal stromal cells. Prostaglandins, Leukotrienes & Essential Fatty Acids 2015;94:91-98.
- Elschner C, Noack C, Preißler C, Krause A, Scheler U, Hempel U. In vitro response of human mesenchymal stem cells to titanium coated PEEK films and their suitability for magnetic resonance imaging. Journal of Materials Science & Technology 2015;5;427-436.
- Miron A, Rother S, Huebner L, Hempel U, Käppler I, Moeller S, Schnabelrauch M, Scharnweber D, Hintze V. Sulfated hyaluronan influences the formation of artificial extracellular matrices and the adhesion of osteogenic cells. Macromol Biosci. 2014 Dec;14(12):1783-94. doi: 10.1002/mabi.201400292. Epub 2014 Sep 12.
- Kalkhof S, Förster Y, Schmidt J, Schulz M, Baumann S, Weißflog A, Gao W, Hempel U, Eckelt U, Rammelt S, Von Bergen M. Proteomics and metabolomics for in situ monitoring of wound healing. Biomed Res Int. 2014;2014:934848.
- Hempel U, Preissler C, Vogel S, Möller S, Hintze V, Becher J, Schnabelrauch M, Rauner M, Hofbauer LC, Dieter P. Artificial extracellular matrices with oversulfated glycosaminoglycan derivatives promote the differentiation of osteoblast-precursor cells and premature osteoblasts. J Biomed Res Int 2014;938368.
- Hempel U, Matthäus C, Preissler C, Möller S, Hintze V, Dieter P. Artificial matrices with high-sulfated glycosaminoglycans and collagen are anti-inflammatory and pro-osteogenic for human mesenchymal stromal cells. J Cell Biochem 2014,115:1561-1571.
- Mai M, Hempel U, Hacker M, Dieter P. Effects of HyStem-HPTM hydrogel elasticity on osteogenic differentiation of human mesenchymal stromal cells. Cell Mol Bioneng 2014;7:155-164.
- Förster Y, Gao W, Demmrich A, Hempel U, Hofbauer LC, Rammelt S. Monitoring the first stages of bone healing with microdialysis. Acta Orthopaedica 2013;84(1):76-81
- Kliemt S, Lange C, Otto W, Hintze V, Möller S, von Bergen M, Hempel U, Kalkhof S. Sulfated hyaluronan containing collagen matrices enhance cell-matrix-interaction, endocytosis, and osteogenic differentiation of human mesenchymal stromal cells. J Proteome Res. 2013;12:378-89.
- Büttner M, Möller S, Keller M, Huster D, Schiller J, Schnabelrauch M, Dieter P, Hempel U. Over-sulfated chondroitin sulfate derivatives induce osteogenic differentiation of human mesenchymal stromal cells independent of bone morphogenetic protein-2 and transforming growth factor-b1 signalling. J Cell Physiology. 2013;228:330-40.
- Hempel U, Möller S, Noack C, Hintze V, Scharnweber S, Schnabelrauch M, Dieter P. Sulfated hyaluronan/collagen I-matrices enhance osteogenic differentiation of human mesenchymal stromal cells in vitro even in the absence of dexamethasone. Acta Biomater. 2012;8:4064-72.
- Hempel U, Hintze V, Möller S, Schnabelrauch M, Scharnweber D, Dieter P. Artificial extracellular matrices composed of collagen I and sulfated hyaluronan with adsorbed TGF-b1 promote collagen synthesis of human mesenchymal stromal cells. Acta Biomater. 2012;8:659-66.
- Salbach J, Rachner T, Rauner M, Hempel U, Anderegg U, Franz S, Simon JC, Hofbauer LC. Regenerative potential of glycosaminoglycans for skin and bone. J Mol Med. 2012;90:620-35.
- Hempel U, Hintze V, Möller S, Schnabelrauch M, Scharnweber D, Dieter P. Artificial extracellular matrices composed of collagen I and sulfated hyaluronan with adsorbed transforming growth factor beta1 promote collagen synthesis of human mesenchymal stromal cells. Acta Biomat. 2012;8:659-66.
- Hamann C, Göttsch C, Mettelsiefen J, Henkenjohann V, Rauner M, Hempel U, Bernhardt R, Fratzl-Zelman N, Roschger P, Rammelt S, Günther KP, Hofbauer LC. Delayed bone regeneration and low bone mass in a rat model of insulin-resistanz type 2 diabetes mellitus is due to impaired osteoblast function. Am J Physiol Endocrinol Metab. 2011;301:e1220-8.
- Goettsch C, Rauner M, Pacyna M, Hempel U, Bornstein SR, Hofbauer LC. mi-R-125b regulates calcification of vascular smooth muscle cells. Am J Pathol. 2011;179:1594-600.Goettsch C, Rauner M, Hamann C, Sinningen K, Hempel U, Bornstein SR, Hofbauer LC. Nuclear factor of activated T cells mediates oxidised LDL-induced calcification of vascular smooth muscle cells. Diabetologia. 2011;54:2690-701.
- Kunze R, Hempel U, Dieter P. Differential Effect of Chondroitin-4-sulfate on the immediate and delayed Prostaglandin E(2) Release from Osteoblasts. Prostaglandins other Lipid Mediat. 2010;epub.
- Lutter AH, Hempel U, Wolf-Brandstetter C, Garbe A, Goettsch C, Hofbauer LC, Jessberger R, Dieter P. A novel resorption assay for osteoclast functionality based on an osteoblast-derived native extracellular matrix. J Cell Biochem. 2010;109:1025-32.
- Kunze R, Rösler M, Möller S, Schnabelrauch M, Riemer T, Hempel U, Dieter P. Sulfated hyaluronan derivatives reduce the proliferation rate of primary rat calvarial osteoblasts. Glycoconj. 2010;27:151-8.
- Helas S, Goettsch C, Schoppet M, Zeitz U, Hempel U, Morawietz H, Kostenuik PJ, Erben RG, Hofbauer LC. Inhibition of Receptor Activator of NF-kappaB Ligand by Denosumab Attenuates Vascular Calcium Deposition in Mice. Am J Pathol. 2009;175:2249.
- Scheffler A-H, Hempel U, Dieter P. Verfahren und Mittel zum Nachweis der Aktivität von Osteoklasten. (Deutsche Patentanmeldung Nr. 10 2009 013 957.5-41)
Kontakt

Dr. rer.nat. Ute Hempel
Wissenschaftliche Mitarbeiterin am Institut für Physiologische Chemie
Medizinische Fakultät der Technischen Universität Dresden
Institut für Physiologische Chemie
Medizinisch-Theoretisches Zentrum
Fiedlerstraße 42, 01307 Dresden
Telefon: +49 (0)351 458-6430
E-Mail: ute.hempel@tu-dresden.de
Web: tu-dresden.de/med/mf/pch/das-institut/arbeitsgruppen/ute-hempel
