A6 – Untersuchung der Wechselwirkung von Mediatoren mit Matrixkomponenten und Analytik der extrazellulären Matrix mittels NMR-Verfahren
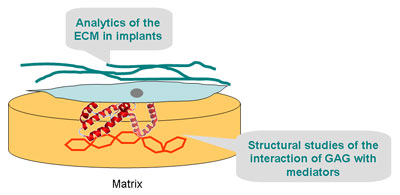
In der 3. Förderperiode sollen die Arbeiten zur strukturbasierten Untersuchung der Wechselwirkungen von regulatorischen Proteinen mit Komponenten der EZM weiter ausgebaut werden. Hauptgegenstand der Arbeiten ist das für die Knochenregeneration bedeutsame Protein Sklerostin. Sklerostin ist ein bekannter Modulator des Wnt-Signalweges und wird im TP B2 intensiv studiert. Wir interessieren uns insbesondere für die Interaktion von Sklerostin mit GAGs. Dazu werden wir Sklerostin rekombinant exprimieren und mit NMR-aktiven Iso-topen (15N, 13C, ggf. 2H) anreichern sowie anschließend Lösungs-NMR-Untersuchungen durchführen. Nach erfolgter Signalzuordnung werden natürliche und artifizielle GAGs zum Protein titriert und die Wechselwirkungsorte am Protein identifiziert.
Neben der experimentellen Bestimmung von Strukturparametern und Bindungskonstanten werden wir in Kooperation mit unseren Partnern im TRR 67 (TP A7) Computerexperimente zum Docking und zur molekularen Dynamik der Protein-GAG-Komplexe durchführen, um Strukturmodelle der Komplexe zu erstellen. Da die Beeinflussung des Wnt-Signalweges über eine Wechselwirkung mit dem Protein LRP5/6 erfolgt, möchten wir untersuchen, wie GAGs diese Proteinkontakte modifizieren können. Dazu werden wir die ersten beiden Propellerdomänen von LRP6 rekombinant herstellen und Bindungsstudien mit Sklerostin in Gegenwart und Abwesenheit von GAGs durchführen. Diffusionsuntersuchungen von regulatorisch wirk-samen Proteinen in Implantatmaterialien werden in der Antragsperiode ausgebaut.
Weiterhin möchten wir den Aufbau von extrazellulärer Matrix in Knochenimplantaten quantitativ unter-suchen. Dazu werden geeignet beschichtete polymerbasierte Matrizes von den Kooperationspartnern im TRR 67 hergestellt und in Tierversuchen implantiert (TPe A1, B2, B5). Nach Explantation erfolgt die Analytik des Aufbaus der de novo-synthetisierten extrazellulären Matrix mittels MRT und NMR-Spektroskopie. Insbesondere interessieren wir uns für das quantitative Monitoring des Aufbaus von Kollagen und Bioapatit in Knochenimplantaten. Es werden Proben aus einem Frakturmodell des Femurschafts der Maus und der Ratte generiert. Damit werden wir das Einwachsen verschieden beschichteter Matrixmaterialien zur Geweberegeneration charakterisieren und den Einfluss der Beschichtung auf den Heilungsprozess quantitativ analysieren.
Publikationen
- Künze G, Huster D, Samsonov SA. Investigation of the structure of regulatory proteins interacting with glycosaminoglycans by combining NMR spectroscopy and molecular modeling – the beginning of a wonderful friendship. Biological Chemistry, vol. 402, no. 11, 2021, pp. 1337-1355. https://doi.org/10.1515/hsz-2021-0119.
- Huster D. Solid-state NMR techniques to study the molecular dynamics in cartilage. In: Xia Y, Momot K. (Eds.): Biophysics and Biochemistry of Cartilage by NMR and MRI. RSC Publishing, Cambridge, 2017, pp. 279-296. (ISBN 978-1-78262-133-1).
- Panitz N, Theisgen S, Samsonov SA, Gehrcke JP, Baumann L, Bellmann-Sickert K, Köhling S, Pisabarro MT, Rademann J, Huster D, Beck-Sickinger AG. The structural investigation of gly-cosaminoglycan binding to CXCL12 displays distinct interaction sites. Glycobiology. 2016; doi: 10.1016/j.actbio.2016.08.030 [Epub ahead of print].
- Hammer N, Huster D, Boldt A, Hädrich C, Koch H, Möbius R, Schulze-Tanzil G, Scheidt HA. A preliminary technical study on sodium dodecyl sulfate-induced changes of the nano-structural and macro-mechanical properties in human iliotibial tract specimens. J Mech Behav Biomed Mater. 2016;61:164-73.
- Köhling S, Künze G, Lemmnitzer K, Bermudez M, Wolber G, Schiller J, Huster D, Rademann J. Chemoenzymatic synthesis of spin-labeled, sulfated tetrahyaluronan for elucidation of its com-plex with interleukin-10. Chemistry. 2016;22:5563-74.
- Künze G, Vogel A, Köhling S, Rademann J, Huster D. Identification of an interleukin-10 gly-cosaminoglycan binding site by NMR spectroscopy. J Biol Chem. 2016; 291:3100-13.
- Nowald C, Penk A, Chiu H, Bein T, Huster D, Lieleg O. A mucin/methylcellulose hybrid gel for applications in wound treatment. Macromol Biosci. 2016;16:567-79.
- Hofmann T, Samsonov SA, Pichert A, Lemmnitzer K, Schiller J, Huster D, Pisabarro MT, von Bergen M, Kalkhof S. Structure analysis of the interleukin-8/glycosaminoglycan complex by amide hydrogen/deuterium exchange mass spectrometry. Methods. 2015;89:45-53.
- Künze G, Gehrcke J-P, Pisabarro MT, Huster D. NMR characterization of the binding proper-ties and conformation of glycosaminoglycans interacting with interleukin-10. Glycobiology. 2014;24:1036-49.
- Samsonov SA, Theisgen S, Riemer T, Huster D, Pisabarro MT. Quantum mechanical, molecu-lar dynamics, and NMR studies of glycosaminoglycans monosaccharide blocks. BioMed Res Int. 2014;2014:808071.
- Künze G, Theisgen S, Huster D. Backbone 1H, 15N, 13C and side chain 13C? NMR chemical shift assignment of murine interleukin-10. Biomol NMR Assign. 2014;8:375-8.
- Kuenze G, Gehrcke JP, Pisabarro MT, Huster D. NMR characterization of the binding properties and conformation of glycosaminoglycans interacting with interleukin-10. Glycobiology, 2014 Jul 6. pii: cwu069. [Epub ahead of print]
- Möbius K, Nordsieck K, Pichert A, Samsonsov SA, Thomas L, Schiller J, Kalkhof S, Pisabarro MT, Beck-Sickinger AG, Huster D. Investigation of lysine side chain interactions of interleukin-8 with heparin and other glycosaminoglycans studied by a methylation-NMR approach. Glycobiology. 2013;23:1260-9.
- Büttner M, Möller S, Keller M, Huster D, Schiller J, Schnabelrauch M, Dieter P, Hempel U. Over-sulfated chondroitin sulfate derivatives induce osteogenic differentiation of human mesenchymal stromal cells independent of bone morphogenetic protein-2 and transforming growth factor-b1 signalling. J Cell Physiology. 2013;228:330-40.
- Förster Y, Scheidt HA, Nimptsch A, Hacker MC, Schulz-Siegmund M, Ahnert P, Schiller J, Rammelt S, Huster D. The pore size of PLGA bone implants determines the de novo formation of bone tissue in tibial head defects in rats. Magn Reson Med. 2012;70:925-35.
- Nordsieck K, Pichert A, Samsonov SA, Thomas L, Berger C, Pisabarro MT, Huster D, Beck-Sickinger AG. Residue 75 of Interleukin-8 is Curicial for the Interaction with Glycosaminoglycans.ChemBioChem. 2012;13:2558-66.
- Penk A, Förster Y, Scheidt HA, Nimptsch A, Hacker M, Schulz-Siegmund M, Ahnert P, Schiller J, Rammelt S, Huster D. The pore size of PLGA bone implants determines the de novo formation of bone tissue in tibial head defects in rats. Magn Resonan Med. 2013; Epub ahead of print.
- Fleddermann J, Pichert A, Arnhold J. Interaction of Serine Proteases from Polymorphonuclear Leucocytes with the Cell Surface and Heparin. Inflammation. 2012;35:81-8.
- Pichert A, Samsonov SA, Theisgen S, Thomas L, Baumann L, Schiller J, Beck-Sickinger AG, Huster D, Pisabarro MT. Characterization of the interaction of the interaction of Interleukin-8 with hyaluronan, chondroitin sulfate, dermatan sulfate, and their sulfated derivatives by spectroscopy and molecular modelling. Glycobiology. 2012;22:134-45.
- Schlorke D, Thomas L, Samsonov S, Huster D, Arnhold J, Pichert A. The Influence of Glycosaminoglycans on IL-8-Mediated Functions of Neutrophils, Carbohydrate Research. 2012;356:196-203. Vlasova II, Sokolov AV, Arnhold J. The free aminon acid tyrosine enhances the chlorinating activity of human myeloperoxidase. J Inorg Chem. 2012;106:76-83.
- Böhme J, Anderegg U, Nimptsch A, Nimptsch K, Hacker M, Schulz-Siegmund M, Huster D, Schiller J. De novo biosynthesis of GAG in the extracellular matrix of skin studied by MALDI MS. Anal Biochem. 2012;421:791-3.
- Weber F, Böhme J, Scheidt HA, Gründer W, Rammelt S, Hacker M, Schulz-Siegmund M, Huster D. 31P and 13C solid state NMR spectroscopy to study collagen synthesis and biomineralization in polymer-based bone implants. NMR Biomed. 2012;25:464-75..
- Flemmig J, Kuchta K, Arnhold J, Rauwald HW. Olea europaea leaf (Ph.eur.) extract as well as several of its isolated phenolics inhibit the gout-related enzyme xanthine oxidase. Phytomedicine. 2011,18:561-66.
- Nimptsch A, Schibur S, Ihling C, Sinz A, Riemer T, Huster D, Schiller J. Quantitative analysis of denatured collagen by collagenase digestion and subsequent MALDI-TOF mass spectrometry. Cell Tissue Res. 2011,343:605-17.
- Yurkova IL, Arnhold J, Fitzl G, Huster D. Fragmentation of mitochondrial cardiolipin by copper ions in the Atp7b-/- mouse model of Wilson’s disease. Chem Phys Lipids. 2011;164:393-400.
- Arnhold J, Flemmig J. Human myeloperoxidase in innate and acquired immunity. Arch Biochem Biophys. 2010;500:92-106.
- Flemmig J, Arnhold J. Interaction of hyperchlorous acid and myeloperoxidase with phosphatidylserine in the presence of ammonium ions. J Inorg Biochem. 2010;104:759-64.
- deAzevedo ER, Ayrosa AM, Faria GC, Cervantes HJ, Huster D, Bonagamba TJ, Pitombo RN, Rabbani SR. The effects ot anticalcification treatments and hydration on the molecular dynamics of bovine pericardium collagen as revealed by 13C solid-state NMR. Magn Reson Chem. 2010;48:704-11.
- Kirchner J, Flemmig J, Furtmüller PG, Obinger C, Arnhold J. (-)-Epicatechin enhances the chlorinating activity of human myeloperoxidase. Arch Biochem Biophys. 2010;495:21-27.
- Nimptsch A, Schibur S, Schnabelrauch M, Fuchs, Huster D, Schiller J. The simple and fast detection of picomole amounts of chondroitin sulphate by MALDI-TOF mass spectrometry subsequent to enzymatic digestion.The signal-to-noise (S/N) ratio as concenetration measure. Anal Chim Acta. 2009;635:175-182.
Kontakt

Prof. Dr. Daniel Huster
Professor für Medizinische Biophysik
Medizinische Fakultät der Universität Leipzig
Institut für Medizinische Physik und Biophysik
Härtelstraße 16 – 18, 04107 Leipzig
Telefon: +49 (0)341 97-15701
E-Mail: daniel.huster@medizin.uni-leipzig.de
Web: biophysik.medizin.uni-leipzig.de
