B4 – Einfluss von artifiziellen extrazellulären Matrizes auf Fibroblastenfunktionen
Fibroblasten synthetisieren den Hauptanteil der extrazellulären Matrix (ECM) und erhalten aus dem Zustand der sie umgebenden ECM wesentliche Stimuli, die den Fibroblastenstoffwechsel modifizieren können. Dazu gehören die ECM-Proteine selbst, deren Degradationsprodukte und in der Matrix vorhandene lösliche Mediatoren anderer Zellen. Aber auch die physikalische Beschaffenheit der ECM kann die Physiologie der eingebetteten Fibroblasten verändern. Es ist anzunehmen, dass das Einbringen von Biomaterialien in ein Gewebe die Homöostase und somit auch den Stoffwechsel von Fibroblasten (FB) modifiziert.
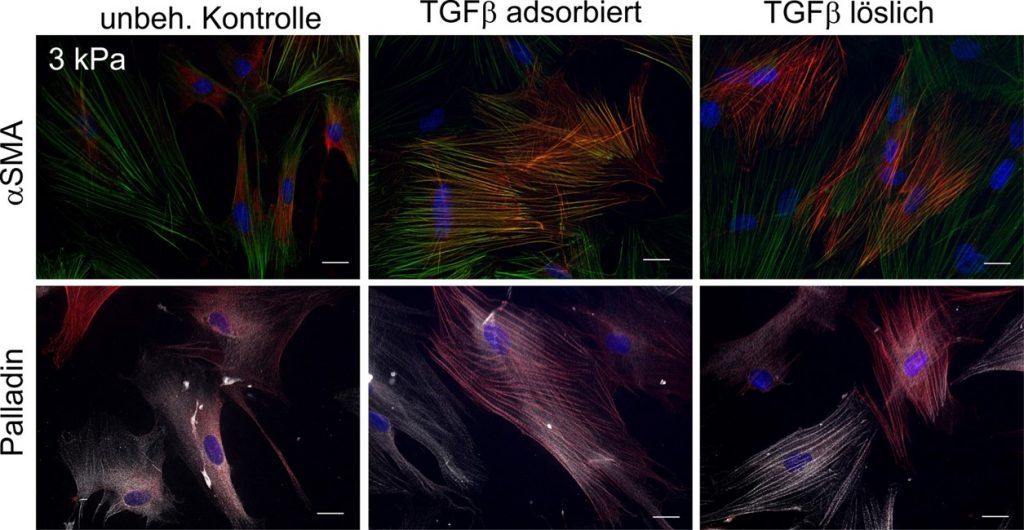
Ziel des Projektes ist es, Vorschläge für Implantatbeschichtungen, die gezielte Immobilisierung von biologisch aktiven Proteinen und Scaffoldstrukturen zu erarbeiten, welche die residenten Matrix-bildenden FB so beeinflusst, dass sie zur effektiven Geweberegeneration befähigt werden. Dabei fokussieren wir uns zunehmend auf die Fähigkeit solcher aECM zur Bindung und Freisetzung wichtiger, die Fibroblastenbiologie beeinflussender Mediatoren im Verlauf der Wundheilung, wie TGF? und HB-EGF. Es wurden Bindungs- und Freisetzungsverhalten ausgewählter Matrizes für diese Zytokine untersucht und in der aktuellen Förderperiode werden Zytokin-freisetzende oder Zytokin-fangende aECM im Fokus stehen.
In Kooperation mit den TPen, die modifizierte GAG, Proteine oder dreidimensionale Scaffolds entwickeln (TPe A1, A3, A10, Z3), wird der Einfluss solcher aECM auf die Biologie dermaler FB in 3D-Systemen oder Organkulturen in vitro und in Maus-Wundheilungsmodellen in vivo untersucht. Dabei stehen die Aktivierung der FB und die Differenzierung zu Myofibroblasten im Vordergrund. Aufgrund der komplexen Regulationsmechanismen bei der Wundheilung werden in Kooperation mit TP B3 jedoch auch Änderungen der Entzündungsantwort durch die aECM untersucht um wundheilungsfördernde Formulierungen für GAG-basierte, mediatorbindende Biomaterialen vorzuschlagen.
Publikationen
- Anderegg U, Halfter N, Schnabelrauch M, Hintze V. Collagen/glycosaminoglycan-based matrices for controlling skin cell responses. Biological Chemistry, vol. 402, no. 11, 2021, pp. 1325-1335. https://doi.org/10.1515/hsz-2021-0176.
- Thönes S, Rother S, Wippold T, Blaszkiewicz J, Balamurugan K, Moeller S, Ruiz-Gómez G, Schnabelrauch M, Scharnweber D, Saalbach A, Rademann J, Pisabarro MT, Hintze V, Anderegg U. Hyaluronan/collagen hydrogels containing sulfated hyaluronan improve wound healing by sustained release of heparin-binding EGF-like growth factor. Acta Biomater. 2019 Mar 1;86:135-147. doi: 10.1016/j.actbio.2019.01.029 . Epub 2019 Jan 17.
- Herbert D, Franz S, Popkova Y, Anderegg U, Schiller J, Schwede K, Lorz A, Simon JC, Saalbach A. High fat diet exacerbates early psoriatic skin inflammation independent of obesity: Saturated fatty acids as key players. J Invest Dermatol. 2018; 138:1999-2009.
- Picke AK, Campbell GM, Blüher M, Krügel U, Schmidt FN, Tsourdi E, Winzer M, Rauner M, Vukicevic V, Busse B, Salbach-Hirsch J, Tuckermann JP, Simon JC, Anderegg U, Hofbauer LC, Saalbach A. Thy-1 (CD90) promotes bone formation and protects against obesity. Sci Transl Med. 2018; 10:eaao6806.
- Picke AK, Campbell GM, Schmidt FN, Busse B, Rauner M, Simon JC, Anderegg U, Hofbauer LC, Saalbach A. Thy-1 Deficiency Augments Bone Loss in Obesity by Affecting Bone Formation and Resorption. Front Cell Dev Biol 2018;6:127.
- Ansorge M, Sapudom J, Chkolnikov M, Wilde M, Anderegg U, Möller S, Schnabelrauch M, Pompe T. Mimicking paracrine TGF-ß1 signals during myofibroblast differentiation in 3D collagen networks. Scientific Reports. 2017, 7:5664.
- Sapudom J, Ullm F, Martin S, Kalbitzer L, Naab J, Möller S, Schnabelrauch M, Anderegg U, Schmidt S, Pompe T. Molecular weight specific impact of soluble and immobilized hyaluronan on CD44 expressing melanoma cells in 3D collagen matrices. Acta Biomater. 2017;50:259-70.
- Thönes S, Kutz LM, Oehmichen S Becher J, Heymann K, Saalbach A, Knolle W, Schnabelrauch M, Reichelt S, Anderegg U. New E-beam-initiated hyaluronan acrylate cryogels sup-port growth and matrix deposition by dermal fibroblasts. Int J Biol Macromol. 2017; 94:611-20.
- Martin S, Wang H, Rathke T, Anderegg U, Möller S, Schnabelrauch M, Pompe T, Schmidt S. Polymer hydrogel particles as biocompatible AFM probes to study CD44 / hyaluronic acid inter-actions on cells. Polymer. 2016;102:342-9.
- Scharnweber D, Hübner L, Rother S, Hempel U, Anderegg U, Samsonov SA, Pisabarro MT, Hofbauer L, Schnabelrauch M, Franz S, Simon J, Hintze V. Glycosaminoglycan derivatives: promising candidates for the design of functional biomaterials. J Mater Sci Mater Med. 2015;26:232.
- Watarai A, Schirmer L, Thönes S, Freudenberg U, Werner C, Simon JC, Anderegg U. TGFß functionalized starPEG-heparin hydrogels modulate human dermal fibroblast growth and differentiation. Acta Biomater. 2015;25:56-75.
- Sapudom J, Rubner S, Martin S, Thönes S, Anderegg U, Pompe T. The interplay of fibronectin functionalization and TGF-ß1 presence on fibroblast proliferation, differentiation and migration in 3D matrices. Biomater Sci. 2015;3:1291-301.
- van der Smissen A, Hoffmeister PG, Friedrich N, Watarai A, Hacker MC, Schulz-Siegmund M, Anderegg U. Artificial extracellular matrices support cell rowth and matrix synthesis of human dermal fibroblasts in macroporous 3D scaffolds. J Tissue Eng Regen Med. 2015;25:56-75.
- Loth T, Hötzel R, Kascholke C, Anderegg U, Schulz-Siegmund M, Hacker MC. Gelatin-based biomaterial engineering with anhydride-containing oligomeric cross-linkers. Biomacromolecules. 2014;15:2104-18
- Anderegg U, Simon JC, Averbeck M. More than just a filler – the role of hyaluronan for skin homeostasis. J Exp. Dermatol. 2014, 23(5):295-303
- Franke K, Sapudom J, Kalbitzer L, Anderegg U, Pompe T. Topologically defined composites of collagen type I and V as in vitro cell culture scaffolds. Acta Biomaterialia 2014, 10(6):2693-702
- Anderegg U, Simon J, Averbeck M. More than just a filler – the role of hyaluronan for skin homeostasis. Exp Dermatol. 2014;23(5):295-303.
- van der Smissen A, Samsonov S, Hintze V, Scharnweber D, Moeller S,Schnabelrauch M, Pisabarro MT, Anderegg U. Artificial extracellular matrix composed of collagen I and highly sulfated hyaluronan interferes with TGF?1 signaling and prevents TGF?1-induced myofibroblast differentiation. Acta Biomater. 2013;9:7775-86.
- Müller SA, van der Smissen A, von Feilitzsch M, Anderegg U, Kalkhof S, von Bergen M. Quantitative proteomics reveals altered expression of extracellular matrix related of proteins of human primary dermal fibroblasts in response to sulphated hyaluronan and collagen applied as artificial extracellular matrix. J Mater Sci Mater Med. 2012;23:3053-65.
- Salbach J, Rachner T, Rauner M, Hempel U, Anderegg U, Franz S, Simon JC, Hofbauer LC. Regenerative potential of glycosaminoglycans for skin and bone. J Mol Med. 2012;90:620-35.
- Böhme J, Anderegg U, Nimptsch A, Nimptsch K, Hacker M, Schulz-Siegmund M, Huster D, Schiller J. De novo biosynthesis of GAG in the extracellular matrix of skin studied by MALDI MS. Anal Biochem. 2012;421:791-3. Van der Smissen A, Hintze V, Scharnweber D, Moeller S, Schnabelrauch M, Majok A, Simon JC, Anderegg U. Growth promoting substrates for human dermal fibroblasts provided by artificial extracellular matrices composed of collagen I and sulfated glycosaminoglycans. Biomaterials. 2011;32:8938-46.
- Willenberg A, Saalbach A, Simon JC, Anderegg U. Melanoma cells control hyaluronan synthesis in peritumoral fibroblasts via PDGF-AA and PDGF-CC: Impact on melanoma cell proliferation. J Invest Dermatol. 2012;132:385-93.
- Gebhardt C, Averbeck M, Diedenhofen N, Willenberg A, Anderegg U, Sleeman JP, Simon JC: Dermal Hyaluronan Is Rapidly Reduced by Topical Treatment with Glucocorticoids. J Invest Dermatol. 2009, 130(1):141-9.
- Anderegg U, Eichenberg T, Parthaune T, Haiduk C, Saalbach A, Milkova L, Ludwig A, Grosche J, Averbeck M, Gebhardt C, Voelcker V, Sleeman JP, Simon JC: ADAM10 is the constitutive functional sheddase of CD44 in human melanoma cells. J Invest Dermatol. 2009;129:1471-1482.
- Saalbach A, Arnhold J, Leßig J, Simon JC, Anderegg U. Human Thy-1 induces secretion of matrix metalloproteinase-9 and CXCL8 from human neutrophils. Eur J Immunol. 2008;38:1-13.
- Kloß D, Kurz RG, Jahnke HG, Fischer M, Rothermel A, Anderegg U, Simon JC, Robitzki AA. Micro cavity array (MCA)-based biosensor chip for functional drug screening of 3D tissue model. Biosens Bioelectron. 2008;23:1473-80.
- Gebhardt C, Averbeck M, Anderegg U and Simon J. Role of Hyaluronan in melanoma progression. In: R. Stern (ed). Seminars in Cancer Biology, 2009, Elsevier San Diego ISBN: 978-0-12-374178-3, 329-339.
- Voelcker V, Gebhardt C, Averbeck M, Saalbach A, Wolf V, Weih F, Sleeman J, Anderegg U and Simon J. Hyaluronan Fragments Induce Cytokine and Metalloprotease Upregulation in Human Melanoma Cells in part by signalling via TLR4. J Exp Dermatol. 2008;17:100-7.
- Saalbach A, Klein C, Sleeman J, Sack U, Kauer F, Gebhardt C, Averbeck M, Anderegg U, Simon JC. Dermal fibroblasts induce maturation of dendritic cells. J Immunol. 2007;178:4966-74.
- Busse K, Averbeck M, Anderegg U, Arnold K, Simon JC, Schiller J The signal-to-noise ratio as a measure of HA oligomer concentration: a MALDI-TOF MS study. Carbohydr Res. 2006;341:1065-1070.
- Sack U, Sehm B, Kahlenberg F, Murr A, Lehmann J, Tannapfel A, Uberla K, Moessner A, Dietrich A, Emmrich F, Lange F, Jungel A, Braun JM, Anderegg U. Investigation of arthritic joint destruction by a novel fibroblast-based model. Ann NY Acad Sci. 2005;1051:291–8.
Kontakt

PD Dr. rer.nat. Ulf Anderegg
Wissenschaftlicher Mitarbeiter und Leiter des Forschungslabors
Medizinische Fakultät
Klinik und Poliklinik für Dermatologie,
Venerologie und Allergologie
Philipp-Rosenthal-Straße 23, 04103 Leipzig
Telefon: +49 (0)341 97-25881
E-Mail: ulf.anderegg@medizin.uni-leipzig.de

Dr. Anja Saalbach
Wissenschaftlicher Mitarbeiterin
Medizinische Fakultät
Klinik und Poliklinik für Dermatologie,
Venerologie und Allergologie
Philipp-Rosenthal-Straße 23, 04103 Leipzig
Telefon: +49 (0)341 97-25880
E-Mail: anja.saalbach@medizin.uni-leipzig.de
