B3 – Immunreaktionen auf native und artifizielle extrazelluläre Matrizes
Das übergeordnete Ziel dieses Projektes ist es artifizielle extrazelluläre Matrizes (aEZM) zu charakterisieren, welche die Funktion von Immunzellen im Sinne einer verbesserten Wundheilung regulieren und somit als immunmodulierende Komponente in Wundauflagen zur Behandlung chronischer Wunden dienen können. Klassischerweise zeigen chronische Wunden eine überschießende Aktivität von Proteasen (MMPs, MPO, neutrophil elastase) und reaktiven Sauerstoffspezies (ROS), die zur Ulzeration des Gewebes führt. Dafür entscheidend ist eine persistierende Entzündungsreaktion, die durch einen Überschuss pro-entzündlicher Zytokine (TNF, IL-1b, MCP-1, IL-8) und die unkontrollierte Einwanderung und Aktivität inflammatorischer Granulozyten (PMN), Monozyten (MO) und Makrophagen (MA) aufrechterhalten wird. Besonders kritisch sind die anhaltende Aktivierung von inflammatorischen M1-MA und die unterdrückte Transition in Richtung wundheilungsfördernder M2-MA, wodurch die Auflösung des Entzündungsprozesses nicht stattfinden kann. Die Modulation der Aktivität von Immunzellen stellt somit einen wichtigen therapeutischen Ansatz dar.
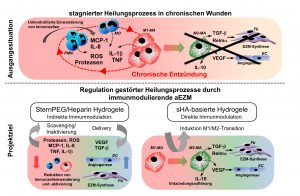
In unseren bisherigen Untersuchungen haben wir aEZM basierend auf sulfatierten Glykosaminglykanen (GAG) mit direkter und indirekter immunmodulierender Wirkung identifiziert und deren Wirkmechanismen aufgeklärt. So modulieren z.B. aEZM auf Basis von Kollagen und artifiziell sulfatierter Hyaluronsäure (sHA) die pro-entzündliche Aktivität von M1-MA und unterstützen die Transition in Richtung wundheilungsfördernder M2-MA. Wir konnten zeigen, dass es sich hierbei um eine direkte anti-entzündliche Immunmodulation handelt, die durch sHA vermittelt wird und unabhängig vom Molekulargewicht der HA ist und über die Einstellung des Sulfatierungsgrades der HA reguliert werden kann. Die Immunmodulation erfolgt über die Erkennung und Aufnahme der sHA mittels CD44 bzw. den Scavenger-Rezeptoren CD36 und LOX-1 und involviert die Aktivierung anti-oxidativer Proteine. Die sHA behandelten M1-MA zeigen trotz pro-entzündlicher Aktivierung eine reduzierte Aktivität inflammatorischer Transkriptionsfaktoren, die zu einer verminderten Freisetzung pro-entzündlicher Zytokine führt und die Produktion anti-entzündlicher Mediatoren unterstützt. Weiterhin haben wir eine indirekte immunmodulierende Wirkung von Hydrogelen basierend auf sternförmigen Polyethylenglykol (sternPEG) und partiell desulfatierten Heparinen festgestellt, die auf der Bindung und funktionellen Neutralisierung (Scavenging) der pro-inflammatorischen Chemokine MCP-1 und IL-8 durch die Heparin-Komponente beruht. Infolge der Inaktivierung der Chemokine modulieren die Hydrogele indirekt die Einwanderung und pro-entzündliche Aktivierung von PMN, MO und MA.
Aufbauend auf diesen Ergebnissen postulieren wir daher, dass durch GAG-basierte aEZM eine Auflösung persistierender Entzündungsreaktionen und eine Unterstützung des Regenerationsprozesses in chronischen Wunden erreicht werden kann. Um die komplexen Entzündungsprozesse in chronischen Wunden regulieren zu können, soll das immunmodulierende Wirkprofil der aEZM zu multifunktionalen Biomaterialien erweitert werden. Konkret verfolgen wir folgende Ansätze:
- Analyse multifunktionaler, mehrphasiger SternPEG/Heparin Hydrogele hinsichtlich einer vielstufigen, phasenadaptierten Immunmodulation in chronischer Wunden
- Entwicklung und Charakterisierung multifunktionaler immunmodulierender sHA-basierter Hydrogele
Die wundheilungsfördernden Effekte dieser neuen aEZM-basierten Biomaterialien werden in Mausmodellen mit einer gestörten Wundheilung basierend auf einem metabolischen Syndrom (db/db) oder einer induzierten chronisch-venösen Insuffizienz (CVI) analysiert. Die Charakterisierung der Wirkprinzipien erfolgt in komplexen Ko-Kultur-Systemen mit humanen Immun- und Gewebezellen und in gut charakterisierten in vivo Modellen chronisch-dermaler Entzündungen. Schließlich sollen in einem translationalen Ansatz die identifizierten Mechanismen an Wundflüssigkeiten und Immunzellen von Patienten mit gestörter Wundheilung (Diabetes mellitus (DM), Chronisch Venöse Insuffizienz (CVI)) ex vivo validiert werden.
Publikationen
- Torregrossa M, Kakpenova A, Simon JC, Franz S. Modulation of macrophage functions by ECM-inspired wound dressings – a promising therapeutic approach for chronic wounds. Biological Chemistry, vol. 402, no. 11, 2021, pp. 1289-1307. https://doi.org/10.1515/hsz-2021-0145.
- Hauck S, Zager P Halfter N, Wandel E, Torregrossa M, Kakpenova A, Rother S, Ordieres M, Räthel S, Berg A, Möller S, Schnabelrauch M, Simon JC, Hintze V, Franz S. Collagen/hyaluronan based hydrogels releasing sulfated hyaluronan improve dermal wound healing in diabetic mice via reducing inflammatory macrophage activity. Bioactive Materials 2021, 6, 4342–4359.DOI: 10.1016/j.bioactmat.2021.04.026.
- Schneider M, Rother S, Möller S, Schnabelrauch M, Scharnweber D, Simon JC, Hintze V, Savkovic V. Sulfated hyaluronan-containing artificial extracellular matrices promote proliferation of keratinocytes and melanotic phenotype of melanocytes from the outer root sheath of hair follicles. J Biomed Mater Res A. 2019 Aug;107(8):1640-1653. doi: 10.1002/jbm.a.36680. Epub 2019 Apr 23.
- Herbert D, Franz S, Popkova Y, Anderegg U, Schiller J, Schwede K, Lorz A, Simon JC, Saalbach A. High fat diet exacerbates early psoriatic skin inflammation independent of obesity: Saturated fatty acids as key players. J Invest Dermatol. 2018; 138:1999-2009.
- Möginger U, Grunewald S, Hennig R, Kuo CW, Schirmeister F, Voth H, Rapp E, Khoo KH, Seeberger P, Simon JC, Kolarich D. Alterations of the human skin N- and O-glycome in basal- and squamous cell carcinoma. Front Oncol. 2018; 8:70.
- Picke AK, Campbell GM, Blüher M, Krügel U, Schmidt FN, Tsourdi E, Winzer M, Rauner M, Vukicevic V, Busse B, Salbach-Hirsch J, Tuckermann JP, Simon JC, Anderegg U, Hofbauer LC, Saalbach A. Thy-1 (CD90) promotes bone formation and protects against obesity. Sci Transl Med. 2018; 10:eaao6806.
- Picke AK, Campbell GM, Schmidt FN, Busse B, Rauner M, Simon JC, Anderegg U, Hofbauer LC, Saalbach A. Thy-1 Deficiency Augments Bone Loss in Obesity by Affecting Bone Formation and Resorption. Front Cell Dev Biol 2018;6:127.
- Schneider M, Lohrenz A, Cross M, Hacker MC, Simon JC, Savkovic V. A human serum-enriched medium formulation supports high viability and marker expression in primary melanocyte cultures from the outer root sheath and epidermis. Exp Dermatol. 2018, 27:87-90.
- Lohmann N, Schirmer L, Atallah P, Wandel E, Ferrer RA, Werner C, Simon JC, Franz S*, Freudenberg U*. Glycosaminoglycan-based hydrogels capture inflammatory chemokines and rescue wound healing deficiency. Sci Transl Med. 2017;9(386). *equal contribution
- Jouy F, Lohmann N, Wandel E, Ruiz-Gómez G, Pisabarro MT, Beck-Sickinger AG, Schnabelrauch M, Moeller S, Simon JC, Kalkhof S, von Bergen M, Franz S. Sulfated hyaluronan attenuates inflammatory signaling pathways in 1 macrophages involving induction of antioxidants. Proteomics. 2017. [Epub ahead of print]
- Ferrer R, Saalbach A, Grünwedel M, Lohmann N, Forstreuter I, Saupe S, Wandel E, Simon JC, Franz S. Dermal fibroblasts promote alternative macrophage activation improving impaired wound healing. J Invest Dermatol. 2017;137:941-950.
- Friedemann M, Kalbitzer L, Franz S, Moeller S, Schnabelrauch M, Simon JC, Pompe T, Franke K. Instructing human macrophage polarization by stiffness and glycosaminoglycan functionalization in 3D collagen networks. Adv Healthc Mater. 2017;6(7).
- Watarai A*, Schirmer L*, Thönes S*, Freudenberg U, Werner C, Simon JC, Anderegg U. TGFß functionalized starPEG-heparin hydrogels modulate human dermal fibroblast growth and differentiation. Acta Biomater. 2015;25:65-75.
- Scharnweber D, Hübner L, Rother S, Hempel U, Anderegg U, Samsonov SA, Pisabarro MT, Hofbauer L, Schnabelrauch M, Franz S, Simon JC, Hintze V. Glycosaminoglycan derivatives: promising candidates for the design of functional biomaterials. J Mater Sci Mater Med. 2015;26:232.
- Franz S, Muñoz LE, Heyder P, Herrmann M, Schiller M. Unconventional apoptosis of polymorphonuclear neutrophils (PMN): staurosporine delays exposure of phosphatidylserine and prevents phagocytosis by Mo-2 macrophages of PMN. Clin Exp Immunol. 2015;179:75-84.
- Savkovic V, Li H, Seon JK, Hacker M, Franz S, Simon JC. Mesenchymal stem cells in cartilage regeneration. Curr Stem Cell Res Ther. 2014;9(6):469-88
- Anderegg U, Simon JC, Averbeck M. More than just a filler – the role of hyaluronan for skin homeostasis. Exp Dermatol. 2014;23:295-303.
- Kajahn J, Franz S, Rückert E, Forstreuter I, Hintze V, Möller S, Simon JC. Artificial extracellular matrices composed of collagen I and high sulfated hyaluronan modulate monocyte to macrophage differentiation under conditions of sterile inflammation. Biomatter. 2012;2:226-36.
- Franz S, Allenstein F, Kajahn J, Forstreuter I, Hintze V, Möller S, Simon JC. Artificial extracellular matrices composed of collagen I and high-sulfated hyaluronan promote phenotypic and functional modulation of human pro-inflammatory M1 macrophages. Acta Biomater. 2012;9:5621-9.
- Savkovic V, Dieckmann C, Milkova L, Simon JC. Improved method of differentiation, selection and amplification of human melanocytes from the hair follicle cell pool. Exp Dermatol. 2012;21:948-76.
- Förster Y, Rentsch C, Schneiders W, Bernhardt R, Simon JC, Huster D, Worch H, Rammelt S. Surface modification of implants in long bone. Biomatter. 2012;2:149-57.
- Pichert A, Schlorke D, Franz S, Arnhold J. Functional aspects of the interaction between interleukin-8 and sulfated glycosaminoglycans. Biomatter. 2012;2:142-8.
- Salbach J, Rachner TD, Rauner M, Hempel U, Anderegg U, Franz S, Simon JC, Hofbauer LC. Regenerative potential of glycosaminoglycans for skin and bone. J Mol Med. 2012;90:625-35.
- Willenberg A, Saalbach A, Simon JC, Anderegg U. Melanoma cells control HA synthesis in peritumoral fibroblasts via PDGF-AA und PDGF-CC: impact on melanoma cell proliferation. J Invest Dermatol. 2012;132:385-93.
- Van der Smissen A, Hintze V, Scharnweber D, Moeller S, Schnabelrauch M, Majok A, Simon JC, Anderegg U. Growth promoting substrates for human dermal fibroblasts provided by artificial extracellular matrices composed of collagen I and sulfated glycosaminoglycans. Biomaterials. 2011;32:8938-46.
- Franz S, Rammelt S, Scharnweber D, Simon JC. Immune responses to implants – A review of the implications for the design of immunomodulatory biomaterials. Biomaterials. 2011;32:6692-709.
- Schirmer C, Klein C, von Bergen M, Simon JC, Saalbach A. Human fibroblasts support the expansion of IL-17-producing T cells via up-regulation of IL-23 production by dendritic cells. Blood. 2010;116:1715-25.
- Dieckmann C, Renner R, Milkova L, Simon JC. Regenerative medicine in dermatology: biomaterials, tissue engineering, stem cells, gene transfer and beyond. Exp Dermatol. 2010;19:697-706.
- Saalbach A, Klein C, Sleeman J, Sack U, Kauer F, Gebhardt C, Averbeck M, Anderegg U, Simon JC. Dermal Fibroblasts Induce Maturation of Dendritic Cells. J Immunol. 2007;178:4966-74.
- Averbeck M, Gebhardt C, Voigt S, Beilharz S, Anderegg U, Ch. Termeer, JP Sleeman, Simon JC. Differential Regulation of Hyaluronan Metabolism in the Epidermal and Dermal Compartments of Human Skin by UVB Irradiation. J Invest. Dermatol. 2007;127:687-97.
- Busse K, Averbeck M, Anderegg U, Arnold K, Simon JC, Schiller J. The signal-t-noise ratio as a measure of Hyaluronan oligomer concentration: a MALDI-TOF MS study. Carbohydr Res. 2006;341:1065-70.
- Fieber C, Baumann P, Vallon R, Termeer, Simon JC, Hofmann M, Angel P, Herrlich P, Sleeman JP. Hyaluronan-oligosaccharide-induced transcription of metalloproteases. J Cell Science. 2004;117:359-67.
- Termeer C, Sleeman JP, Simon JC. Hyaluronan – magic glue for the regulation of the immune response? Trends Immunol. 2003;24:112-14.
- Termeer C, Benedix F, Sleeman J, Fieber C, Voith U, Ahrens T, Miyake K, Freudenberg M, Galanos C, Simon JC. Oligosaccharides of Hyaluronan activate Dendritic Cells via the Toll-like Receptor 4. J Exp Med. 2002;195:99-111.
- Weiss JM, Renkl AC, Ahrens T, Moll J, Mai B, Denfeld RW, Schöpf E, Ponta H, Herrlich P, Simon JC. Activation-dependent modulation of hyaluronate receptor expression and hyaluronate avidity by human monocytes. J Invest Dermatol. 1998;111:227-32.
Kontakt

Prof. Dr. med. Jan-Christoph Simon
Professor für Dermatologie, Venerologie und Allergologie
Medizinische Fakultät der Universität Leipzig
Klinik für Dermatologie, Venerologie und Dermatologie
Philipp-Rosenthal-Straße 23, 04103 Leipzig
Telefon: +49 (0)341 97-18600
E-Mail: jan.simon@medizin.uni-leipzig.de
Web: www.uniklinikum-leipzig.de/einrichtungen/dermatologie

PD Dr. rer.nat. Sandra Franz
Gruppenleiterin und Wissenschaftliche Mitarbeiterin
Universität Leipzig
Klinik für Dermatologie, Venerologie und Allergologie
Max-Bürger-Forschungszentrum
Johannisallee 30, 04103 Leipzig
Telefon: +49 341 97 25880
E-Mail: sandra.franz@medizin.uni-leipzig.de
Web: www.uniklinikum-leipzig.de/einrichtungen/dermatologie
